氙 (Xe)
无色气体,在高压放电管中呈现紫蓝色
![元素[氙(Xe)]](/element/element-7bf25581591cb00ca46bc59e0ab8dcad.jpg)
![元素[氙(Xe)]](/element/element-7bf25581591cb00ca46bc59e0ab8dcad.jpg)
基本資訊
| 原子序數 | 54 | 英文名 | Xenon |
|---|---|---|---|
| 所屬分類 | 稀有气体 | 原子量 | 131.293 u |
| 熔點 | -111.8 °C | 沸點 | -108 °C |
| 能級 | 2, 8, 18, 18, 8 | 電負性 | 2.6 |
| 電子親和能 | 0 kJ/mol | 半徑(計算法) | 108 pm |
| 電離能 |
第1电离能: 1170.4 kJ/mol
第2电离能: 2046.4 kJ/mol
第3电离能: 3099.4 kJ/mol
|
||
| 密度(常規) | 5.9 kg/m³ | 硬度(布式) | N/A |
| 體積模量 | N/A | 導熱率 | 0.00565 W/mK |
| 宇宙存量百分比 | 1.00E-6 % | ||
氙氣是一種無色、無味、無毒且化學性質穩定的惰性氣體,在常溫常壓下以單原子氣體形態存在。 其密度顯著大於空氣,約為空氣的4.5倍,不易溶於水,但能溶於某些有機溶劑,並具有較高的電離能和電負性。 在紫外光照射下,氙氣會產生獨特的藍色冷光效應。 氙氣因其高效的發光性能和較長的壽命,在多個領域有廣泛應用。 在照明方面,氙氣常被用於車輛頭燈、放映機和手術室照明系統中,提供明亮且持久的光源。 同時,氙氣也是氙離子雷射的關鍵填充氣體,在醫學研究、工業生產和研究活動中發揮重要作用。 此外,氙氣的獨特性質使其成為了太空航太領域氙氣離子引擎的理想推進劑,尤其在太陽帆推進技術中起到關鍵推動作用。 氙氣的製備通常透過液化空氣分餾法來實現。 在這個過程中,隨著溫度的逐步降低和壓力的逐漸升高,空氣中的氮氣、氧氣、氬氣等成分被逐一分離,氙氣作為其中稀有氣體組分之一得以提取。 儘管氙氣本身屬於惰性氣體,不易引燃,但在實際使用上仍需高度重視安全。 由於氙氣無色無味,難以察覺其洩露,所以在封閉空間使用時必須採取必要的防護措施,防止氧氣濃度下降引發窒息風險。 尤其在高濃度氙氣環境中,其對氧氣的擠佔可能導致窒息的危險。 因此,氙氣的儲存和使用應確保在通風良好的區域進行,並避免因氣體積聚帶來的火災或爆炸隱患。 總之,透過合理使用並採取適當的安全預防措施,可以確保氙氣在各領域應用過程中的安全性。
更多資訊
| 標準原子質量 | 131.293(6) |
|---|---|
| 電子排布 | [Kr] 4d10 5s2 5p6 2, 8, 18, 18, 8 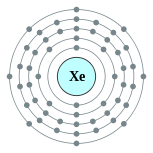 |
| 發現 | 威廉·拉姆齊和莫里斯·特拉弗斯(1898年) |
| 分離 | 威廉·拉姆齊和莫里斯·特拉弗斯(1898年) |
| 物態 | 氣態 |
| 密度 | (0 °C, 101.325 kPa) 5.894 g/L |
| 三相點 | 161.405 K(−112 °C),81.6 kPa |
| 臨界點 | 289.77 K,5.841 MPa |
| 熔化熱 | (101.325 kPa)2.27 kJ·mol−1 |
| 汽化熱 | (101.325 kPa)12.64 kJ·mol−1 |
| 比熱容 | 5R/2 = 20.786 J·mol−1·K−1 |
| 氧化態 | 0, +1, +2, +4, +6, +8 (很少大於0) (氧化物具弱酸性) |
| 電負性 | 2.6(鮑林標度) |
| 共價半徑 | 140±9 pm |
| 范德華半徑 | 216 pm |
| 晶體結構 | 面心立方 |
| 磁序 | 抗磁性 |
| 聲速 | (液態)1090 m/s;(氣態)169 m·s−1 |
元素清單
1號元素-氫(H)
2號元素-氦(He)
3號元素-鋰(Li)
4號元素-鈹(Be)
5號元素-硼(B)
6號元素-碳(C)
7號元素-氮(N)
8號元素-氧(O)
9號元素-氟(F)
10號元素-氖(Ne)
11號元素-鈉(Na)
12號元素-鎂(Mg)
13號元素-鋁(Al)
14號元素-矽(Si)
15號元素-磷(P)
16號元素-硫(S)
17號元素-氯(Cl)
18號元素-氬(Ar)
19號元素-鉀(K)
20號元素-鈣(Ca)
21號元素-鈧(Sc)
22號元素-鈦(Ti)
23號元素-釩(V)
24號元素-鉻(Cr)
25號元素-錳(Mn)
26號元素-鐵(Fe)
27號元素-鈷(Co)
28號元素-鎳(Ni)
29號元素-銅(Cu)
30號元素-鋅(Zn)
31號元素-鎵(Ga)
32號元素-鍺(Ge)
33號元素-砷(As)
34號元素-硒(Se)
35號元素-溴(Br)
36號元素-氪(Kr)
37號元素-銣(Rb)
38號元素-鍶(Sr)
39號元素-釔(Y)
40號元素-鋯(Zr)
41號元素-鈮(Nb)
42號元素-鉬(Mo)
43號元素-鍀(Tc)
44號元素-釕(Ru)
45號元素-銠(Rh)
46號元素-鈀(Pd)
47號元素-銀(Ag)
48號元素-鎘(Cd)
49號元素-銦(In)
50號元素-錫(Sn)
51號元素-銻(Sb)
52號元素-碲(Te)
53號元素-碘(I)
54號元素-氙(Xe)
55號元素-銫(Cs)
56號元素-鋇(Ba)
57號元素-鑭(La)
58號元素-鈰(Ce)
59號元素-鐠(Pr)
60號元素-釹(Nd)
61號元素-鉕(Pm)
62號元素-釤(Sm)
63號元素-銪(Eu)
64號元素-釓(Gd)
65號元素-鋱(Tb)
66號元素-鏑(Dy)
67號元素-钬(Ho)
68號元素-鉺(Er)
69號元素-銩(Tm)
70號元素-鐿(Yb)
71號元素-鑥(Lu)
72號元素-鉿(Hf)
73號元素-鉭(Ta)
74號元素-鎢(W)
75號元素-錸(Re)
76號元素-鋨(Os)
77號元素-銥(Ir)
78號元素-鉑(Pt)
79號元素-金(Au)
80號元素-汞(Hg)
81號元素-鉈(Tl)
82號元素-鉛(Pb)
83號元素-鉍(Bi)
84號元素-釙(Po)
85號元素-砹(At)
86號元素-氡(Rn)
87號元素-鈁(Fr)
88號元素-鐳(Ra)
89號元素-錒(Ac)
90號元素-釷(Th)
91號元素-鏷(Pa)
92號元素-鈾(U)
93號元素-鎿(Np)
94號元素-鈈(Pu)
95號元素-鎇(Am)
96號元素-鋦(Cm)
97號元素-錇(Bk)
98號元素-鐦(Cf)
99號元素-鎄(Es)
100號元素-鐨(Fm)
101號元素-鍆(Md)
102號元素-鍩(No)
103號元素-鐒(Lr)
104號元素-鑪(Rf)
105號元素-𨧀(Db)
106號元素-𨭎(Sg)
107號元素-𨨏(Bh)
108號元素-𨭆(Hs)
109號元素-䥑(Mt)
110號元素-鐽(Ds)
111號元素-錀(Rg)
112號元素-鎶(Cn)
113號元素-鉨(Nh)
114號元素-鈇(Fl)
115號元素-鏌(Mc)
116號元素-鉝(Lv)
117號元素-鿬(Ts)
118號元素-鿫(Og)