氙 (Xe)
无色气体,在高压放电管中呈现紫蓝色
![元素[氙(Xe)]](/element/element-7bf25581591cb00ca46bc59e0ab8dcad.jpg)
![元素[氙(Xe)]](/element/element-7bf25581591cb00ca46bc59e0ab8dcad.jpg)
基本信息
| 原子序数 | 54 | 英文名 | Xenon |
|---|---|---|---|
| 所属分类 | 稀有气体 | 原子量 | 131.293 u |
| 熔点 | -111.8 °C | 沸点 | -108 °C |
| 能级 | 2, 8, 18, 18, 8 | 电负性 | 2.6 |
| 电子亲和能 | 0 kJ/mol | 半径(计算法) | 108 pm |
| 电离能 |
第1电离能: 1170.4 kJ/mol
第2电离能: 2046.4 kJ/mol
第3电离能: 3099.4 kJ/mol
|
||
| 密度(常规) | 5.9 kg/m³ | 硬度(布式) | N/A |
| 体积模量 | N/A | 导热率 | 0.00565 W/mK |
| 宇宙存量百分比 | 1.00E-6 % | ||
氙气是一种无色、无味、无毒且化学性质稳定的惰性气体,在常温常压下以单原子气体形态存在。其密度显著大于空气,约为空气的4.5倍,不易溶于水,但能溶于某些有机溶剂,并具有较高的电离能和电负性。在紫外光照射下,氙气会产生独特的蓝色冷光效应。 氙气因其高效的发光性能和较长的寿命,在多个领域有着广泛应用。在照明方面,氙气常被用于车辆前照灯、放映机和手术室照明系统中,提供明亮且持久的光源。同时,氙气也是氙离子激光器的关键填充气体,在医学研究、工业生产和科研活动中发挥重要作用。此外,氙气的独特性质使其成为了太空航天领域氙气离子引擎的理想推进剂,尤其在太阳风帆推进技术中起到关键推动作用。 氙气的制备通常通过液化空气分馏法实现。在这个过程中,随着温度的逐步降低和压力的逐渐升高,空气中的氮气、氧气、氩气等成分被逐一分离,氙气作为其中稀有气体组分之一得以提取。 尽管氙气本身属于惰性气体,不易引燃,但在实际使用中仍需高度重视安全。由于氙气无色无味,难以察觉其泄露,所以在封闭空间使用时必须采取必要的防护措施,防止氧气浓度下降引发窒息风险。尤其在高浓度氙气环境中,其对氧气的挤占可能导致窒息的危险。因此,氙气的储存和使用应确保在通风良好的区域进行,避免因气体积聚带来的火灾或爆炸隐患。总之,通过合理使用并采取适当的安全预防措施,可以确保氙气在各领域应用过程中的安全性。
更多信息
| 电子排布 | [Kr] 4d10 5s2 5p6 2, 8, 18, 18, 8 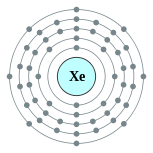 |
|---|---|
| 发现 | 威廉·拉姆齐和莫里斯·特拉弗斯(1898年) |
| 分离 | 威廉·拉姆齐和莫里斯·特拉弗斯(1898年) |
| 物态 | 气态 |
| 密度 | (0 °C, 101.325 kPa) 5.894 g/L |
| 三相点 | 161.405 K(−112 °C),81.6 kPa |
| 临界点 | 289.77 K,5.841 MPa |
| 熔化热 | (101.325 kPa)2.27 kJ·mol−1 |
| 汽化热 | (101.325 kPa)12.64 kJ·mol−1 |
| 比热容 | 5R/2 = 20.786 J·mol−1·K−1 |
| 氧化态 | 0, +1, +2, +4, +6, +8 (很少大于0) (氧化物具弱酸性) |
| 电负性 | 2.6(鲍林标度) |
| 共价半径 | 140±9 pm |
| 范德华半径 | 216 pm |
| 晶体结构 | 面心立方 |
| 磁序 | 抗磁性 |
| 声速 | (液态)1090 m/s;(气态)169 m·s−1 |
元素列表
1号元素-氢(H)
2号元素-氦(He)
3号元素-锂(Li)
4号元素-铍(Be)
5号元素-硼(B)
6号元素-碳(C)
7号元素-氮(N)
8号元素-氧(O)
9号元素-氟(F)
10号元素-氖(Ne)
11号元素-钠(Na)
12号元素-镁(Mg)
13号元素-铝(Al)
14号元素-硅(Si)
15号元素-磷(P)
16号元素-硫(S)
17号元素-氯(Cl)
18号元素-氩(Ar)
19号元素-钾(K)
20号元素-钙(Ca)
21号元素-钪(Sc)
22号元素-钛(Ti)
23号元素-钒(V)
24号元素-铬(Cr)
25号元素-锰(Mn)
26号元素-铁(Fe)
27号元素-钴(Co)
28号元素-镍(Ni)
29号元素-铜(Cu)
30号元素-锌(Zn)
31号元素-镓(Ga)
32号元素-锗(Ge)
33号元素-砷(As)
34号元素-硒(Se)
35号元素-溴(Br)
36号元素-氪(Kr)
37号元素-铷(Rb)
38号元素-锶(Sr)
39号元素-钇(Y)
40号元素-锆(Zr)
41号元素-铌(Nb)
42号元素-钼(Mo)
43号元素-锝(Tc)
44号元素-钌(Ru)
45号元素-铑(Rh)
46号元素-钯(Pd)
47号元素-银(Ag)
48号元素-镉(Cd)
49号元素-铟(In)
50号元素-锡(Sn)
51号元素-锑(Sb)
52号元素-碲(Te)
53号元素-碘(I)
54号元素-氙(Xe)
55号元素-铯(Cs)
56号元素-钡(Ba)
57号元素-镧(La)
58号元素-铈(Ce)
59号元素-镨(Pr)
60号元素-钕(Nd)
61号元素-钷(Pm)
62号元素-钐(Sm)
63号元素-铕(Eu)
64号元素-钆(Gd)
65号元素-铽(Tb)
66号元素-镝(Dy)
67号元素-钬(Ho)
68号元素-铒(Er)
69号元素-铥(Tm)
70号元素-镱(Yb)
71号元素-镥(Lu)
72号元素-铪(Hf)
73号元素-钽(Ta)
74号元素-钨(W)
75号元素-铼(Re)
76号元素-锇(Os)
77号元素-铱(Ir)
78号元素-铂(Pt)
79号元素-金(Au)
80号元素-汞(Hg)
81号元素-铊(Tl)
82号元素-铅(Pb)
83号元素-铋(Bi)
84号元素-钋(Po)
85号元素-砹(At)
86号元素-氡(Rn)
87号元素-钫(Fr)
88号元素-镭(Ra)
89号元素-锕(Ac)
90号元素-钍(Th)
91号元素-镤(Pa)
92号元素-铀(U)
93号元素-镎(Np)
94号元素-钚(Pu)
95号元素-镅(Am)
96号元素-锔(Cm)
97号元素-锫(Bk)
98号元素-锎(Cf)
99号元素-锿(Es)
100号元素-镄(Fm)
101号元素-钔(Md)
102号元素-锘(No)
103号元素-铹(Lr)
104号元素-𬬻(Rf)
105号元素-𬭊(Db)
106号元素-𬭳(Sg)
107号元素-𬭛(Bh)
108号元素-𬭶(Hs)
109号元素-鿏(Mt)
110号元素-𫟼(Ds)
111号元素-𬬭(Rg)
112号元素-鿔(Cn)
113号元素-鿭(Nh)
114号元素-𫓧(Fl)
115号元素-镆(Mc)
116号元素-𫟷(Lv)
117号元素-鿬(Ts)
118号元素-鿫(Og)