氮 (N)
气体,液体及固体均为无色
![元素[氮(N)]](/element/element-4d806d1a94497fb5bdaf1c80ed4cb6bc.jpg) 液态氮
液态氮
![元素[氮(N)]](/element/element-4d806d1a94497fb5bdaf1c80ed4cb6bc.jpg) 液态氮
液态氮
基本資訊
| 原子序數 | 7 | 英文名 | Nitrogen |
|---|---|---|---|
| 所屬分類 | 活泼非金属 | 原子量 | 14.007 u |
| 熔點 | -210.1 °C | 沸點 | -195.8 °C |
| 能級 | 2, 5 | 電負性 | 3.04 |
| 電子親和能 | 7 kJ/mol | 半徑(計算法) | 56 pm |
| 電離能 |
第1电离能: 1402.3 kJ/mol
第2电离能: 2856 kJ/mol
第3电离能: 4578.1 kJ/mol
第4电离能: 7475.0 kJ/mol
第5电离能: 9444.9 kJ/mol
第6电离能: 53266.6 kJ/mol
第7电离能: 64360 kJ/mol
|
||
| 密度(常規) | 1.251 kg/m³ | 硬度(布式) | N/A |
| 體積模量 | N/A | 導熱率 | 0.02583 W/mK |
| 宇宙存量百分比 | 0.100 % | ||
氮,作為一種非金屬元素,其化學符號為N,原子序為7,在自然界中扮演至關重要的角色。 在物理性質方面,氮呈現為無色、無味且無毒的氣體狀態,通常以雙原子分子形式即氮氣(N2)存在於大氣中,佔據著大約78%的空氣體積比例,是地球大氣層的主要 成分。 從化學角度而言,氮氣具有很高的化學穩定性,不易與大多數元素發生自發性反應,僅在高溫高壓條件或藉助電弧放電等特殊手段下才可能與其他物質相互作用。 在實際應用上,氮氣的用途十分廣泛。 作為工業化學品,它常作為惰性氣體被廣泛應用於各類工業製程中,有效地防止物質氧化、腐蝕以及因氧氣存在可能導致的爆炸事故。 此外,在食品加工業中,氮氣普遍用於食品包裝與保存,以此延緩食品變質,保障食品的新鮮度與保存期限。 在科研實驗室環境中,氮氣也是製備和維護某些特殊材料的重要輔助氣體。 氮氣的大規模工業生產主要依靠空分設備完成,該技術基於氣體分子質量和吸附特性差異,透過分子篩等介質將空氣中的氮氣與其它氣體有效分離。 在安全使用氮氣時,有幾個關鍵要點值得注意:儘管純淨氮氣本身無害且非易燃,但其高濃度會導致人體缺氧窒息,尤其在封閉或通風不良的環境中,操作者必須 格外謹慎。 此外,長時間吸入氮氣可能會引發缺氧危險。 另外,氮氣在極低溫下會帶來冷燙傷的風險,因此,在與液態氮或極冷氮氣接觸時,操作員應配戴合適的個人防護裝備,避免直接皮膚接觸,以確保作業安全。
更多資訊
| 標準原子質量 | 14.007(1) |
|---|---|
| 電子排布 | [氦]2s2 2p3 2, 5 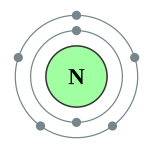 |
| 發現 | 丹尼爾·盧瑟福(1772年) |
| 命名 | 讓-安托萬·沙普塔(1790年) |
| 物態 | 氣態 |
| 密度 | (0 °C, 101.325 kPa) 1.2506 g/L |
| 三相點 | 63.1526 K(−210 °C),12.53 kPa |
| 臨界點 | 126.19 K,3.3978 MPa |
| 熔化熱 | (N2)0.72 kJ·mol−1 |
| 汽化熱 | (N2)5.56 kJ·mol−1 |
| 比熱容 | (N2) 29.124 J·mol−1·K−1 |
| 氧化態 | −3、−2、−1、0、+1、+2、+3、+4、+5 (強酸性) |
| 電負性 | 3.04(鮑林標度) |
| 共價半徑 | 71±1 pm |
| 范德華半徑 | 155 pm |
| 晶體結構 | 六方 |
| 磁序 | 抗磁性 |
| 聲速 | (氣態,27 °C)353 m·s−1 |
| CAS號 | 7727-37-9 |
元素清單
1號元素-氫(H)
2號元素-氦(He)
3號元素-鋰(Li)
4號元素-鈹(Be)
5號元素-硼(B)
6號元素-碳(C)
7號元素-氮(N)
8號元素-氧(O)
9號元素-氟(F)
10號元素-氖(Ne)
11號元素-鈉(Na)
12號元素-鎂(Mg)
13號元素-鋁(Al)
14號元素-矽(Si)
15號元素-磷(P)
16號元素-硫(S)
17號元素-氯(Cl)
18號元素-氬(Ar)
19號元素-鉀(K)
20號元素-鈣(Ca)
21號元素-鈧(Sc)
22號元素-鈦(Ti)
23號元素-釩(V)
24號元素-鉻(Cr)
25號元素-錳(Mn)
26號元素-鐵(Fe)
27號元素-鈷(Co)
28號元素-鎳(Ni)
29號元素-銅(Cu)
30號元素-鋅(Zn)
31號元素-鎵(Ga)
32號元素-鍺(Ge)
33號元素-砷(As)
34號元素-硒(Se)
35號元素-溴(Br)
36號元素-氪(Kr)
37號元素-銣(Rb)
38號元素-鍶(Sr)
39號元素-釔(Y)
40號元素-鋯(Zr)
41號元素-鈮(Nb)
42號元素-鉬(Mo)
43號元素-鍀(Tc)
44號元素-釕(Ru)
45號元素-銠(Rh)
46號元素-鈀(Pd)
47號元素-銀(Ag)
48號元素-鎘(Cd)
49號元素-銦(In)
50號元素-錫(Sn)
51號元素-銻(Sb)
52號元素-碲(Te)
53號元素-碘(I)
54號元素-氙(Xe)
55號元素-銫(Cs)
56號元素-鋇(Ba)
57號元素-鑭(La)
58號元素-鈰(Ce)
59號元素-鐠(Pr)
60號元素-釹(Nd)
61號元素-鉕(Pm)
62號元素-釤(Sm)
63號元素-銪(Eu)
64號元素-釓(Gd)
65號元素-鋱(Tb)
66號元素-鏑(Dy)
67號元素-钬(Ho)
68號元素-鉺(Er)
69號元素-銩(Tm)
70號元素-鐿(Yb)
71號元素-鑥(Lu)
72號元素-鉿(Hf)
73號元素-鉭(Ta)
74號元素-鎢(W)
75號元素-錸(Re)
76號元素-鋨(Os)
77號元素-銥(Ir)
78號元素-鉑(Pt)
79號元素-金(Au)
80號元素-汞(Hg)
81號元素-鉈(Tl)
82號元素-鉛(Pb)
83號元素-鉍(Bi)
84號元素-釙(Po)
85號元素-砹(At)
86號元素-氡(Rn)
87號元素-鈁(Fr)
88號元素-鐳(Ra)
89號元素-錒(Ac)
90號元素-釷(Th)
91號元素-鏷(Pa)
92號元素-鈾(U)
93號元素-鎿(Np)
94號元素-鈈(Pu)
95號元素-鎇(Am)
96號元素-鋦(Cm)
97號元素-錇(Bk)
98號元素-鐦(Cf)
99號元素-鎄(Es)
100號元素-鐨(Fm)
101號元素-鍆(Md)
102號元素-鍩(No)
103號元素-鐒(Lr)
104號元素-鑪(Rf)
105號元素-𨧀(Db)
106號元素-𨭎(Sg)
107號元素-𨨏(Bh)
108號元素-𨭆(Hs)
109號元素-䥑(Mt)
110號元素-鐽(Ds)
111號元素-錀(Rg)
112號元素-鎶(Cn)
113號元素-鉨(Nh)
114號元素-鈇(Fl)
115號元素-鏌(Mc)
116號元素-鉝(Lv)
117號元素-鿬(Ts)
118號元素-鿫(Og)