氮 (N)
气体,液体及固体均为无色
![元素[氮(N)]](/element/element-4d806d1a94497fb5bdaf1c80ed4cb6bc.jpg) 液态氮
液态氮
![元素[氮(N)]](/element/element-4d806d1a94497fb5bdaf1c80ed4cb6bc.jpg) 液态氮
液态氮
基本信息
| 原子序数 | 7 | 英文名 | Nitrogen |
|---|---|---|---|
| 所属分类 | 活泼非金属 | 原子量 | 14.007 u |
| 熔点 | -210.1 °C | 沸点 | -195.8 °C |
| 能级 | 2, 5 | 电负性 | 3.04 |
| 电子亲和能 | 7 kJ/mol | 半径(计算法) | 56 pm |
| 电离能 |
第1电离能: 1402.3 kJ/mol
第2电离能: 2856 kJ/mol
第3电离能: 4578.1 kJ/mol
第4电离能: 7475.0 kJ/mol
第5电离能: 9444.9 kJ/mol
第6电离能: 53266.6 kJ/mol
第7电离能: 64360 kJ/mol
|
||
| 密度(常规) | 1.251 kg/m³ | 硬度(布式) | N/A |
| 体积模量 | N/A | 导热率 | 0.02583 W/mK |
| 宇宙存量百分比 | 0.100 % | ||
氮,作为一种非金属元素,其化学符号为N,原子序数为7,在自然界中扮演着至关重要的角色。在物理性质方面,氮呈现为无色、无味且无毒的气体状态,通常以双原子分子形式即氮气(N2)存在于大气中,占据着大约78%的空气体积比例,是地球大气层的主要成分。 从化学角度而言,氮气具有很高的化学稳定性,不易与大多数元素发生自发反应,仅在高温高压条件或是借助电弧放电等特殊手段下才可能与其他物质相互作用。 在实际应用上,氮气的用途十分广泛。作为工业化学品,它常作为惰性气体被广泛应用于各类工业过程中,有效地防止物质氧化、腐蚀以及因氧气存在可能导致的爆炸事故。此外,在食品加工业中,氮气被普遍用于食品包装与保存,以此延缓食品变质,保障食品的新鲜度和保质期。在科研实验室环境中,氮气也是制备和维护某些特殊材料的重要辅助气体。 氮气的大规模工业生产主要依靠空分设备完成,该技术基于气体分子质量和吸附特性差异,通过分子筛等介质将空气中的氮气与其它气体有效分离。 在安全使用氮气时,有几个关键要点值得注意:尽管纯净氮气本身无害且非易燃,但其高浓度会导致人体缺氧窒息,尤其在封闭或通风不畅的环境中,操作者必须格外谨慎。此外,长时间吸入氮气可能会引发缺氧危险。另外,氮气在极低温度下会带来冷烫伤的风险,因此,在与液氮或极冷氮气接触时,操作人员应当佩戴合适的个人防护装备,避免直接皮肤接触,以确保作业安全。
更多信息
| 电子排布 | [氦]2s2 2p3 2, 5 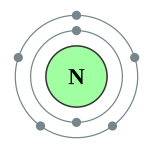 |
|---|---|
| 发现 | 丹尼尔·卢瑟福(1772年) |
| 命名 | 让-安托万·沙普塔(1790年) |
| 物态 | 气态 |
| 密度 | (0 °C, 101.325 kPa) 1.2506 g/L |
| 三相点 | 63.1526 K(−210 °C),12.53 kPa |
| 临界点 | 126.19 K,3.3978 MPa |
| 熔化热 | (N2)0.72 kJ·mol−1 |
| 汽化热 | (N2)5.56 kJ·mol−1 |
| 比热容 | (N2) 29.124 J·mol−1·K−1 |
| 氧化态 | −3、−2、−1、0、+1、+2、+3、+4、+5 (强酸性) |
| 电负性 | 3.04(鲍林标度) |
| 共价半径 | 71±1 pm |
| 范德华半径 | 155 pm |
| 晶体结构 | 六方 |
| 磁序 | 抗磁性 |
| 声速 | (气态,27 °C)353 m·s−1 |
元素列表
1号元素-氢(H)
2号元素-氦(He)
3号元素-锂(Li)
4号元素-铍(Be)
5号元素-硼(B)
6号元素-碳(C)
7号元素-氮(N)
8号元素-氧(O)
9号元素-氟(F)
10号元素-氖(Ne)
11号元素-钠(Na)
12号元素-镁(Mg)
13号元素-铝(Al)
14号元素-硅(Si)
15号元素-磷(P)
16号元素-硫(S)
17号元素-氯(Cl)
18号元素-氩(Ar)
19号元素-钾(K)
20号元素-钙(Ca)
21号元素-钪(Sc)
22号元素-钛(Ti)
23号元素-钒(V)
24号元素-铬(Cr)
25号元素-锰(Mn)
26号元素-铁(Fe)
27号元素-钴(Co)
28号元素-镍(Ni)
29号元素-铜(Cu)
30号元素-锌(Zn)
31号元素-镓(Ga)
32号元素-锗(Ge)
33号元素-砷(As)
34号元素-硒(Se)
35号元素-溴(Br)
36号元素-氪(Kr)
37号元素-铷(Rb)
38号元素-锶(Sr)
39号元素-钇(Y)
40号元素-锆(Zr)
41号元素-铌(Nb)
42号元素-钼(Mo)
43号元素-锝(Tc)
44号元素-钌(Ru)
45号元素-铑(Rh)
46号元素-钯(Pd)
47号元素-银(Ag)
48号元素-镉(Cd)
49号元素-铟(In)
50号元素-锡(Sn)
51号元素-锑(Sb)
52号元素-碲(Te)
53号元素-碘(I)
54号元素-氙(Xe)
55号元素-铯(Cs)
56号元素-钡(Ba)
57号元素-镧(La)
58号元素-铈(Ce)
59号元素-镨(Pr)
60号元素-钕(Nd)
61号元素-钷(Pm)
62号元素-钐(Sm)
63号元素-铕(Eu)
64号元素-钆(Gd)
65号元素-铽(Tb)
66号元素-镝(Dy)
67号元素-钬(Ho)
68号元素-铒(Er)
69号元素-铥(Tm)
70号元素-镱(Yb)
71号元素-镥(Lu)
72号元素-铪(Hf)
73号元素-钽(Ta)
74号元素-钨(W)
75号元素-铼(Re)
76号元素-锇(Os)
77号元素-铱(Ir)
78号元素-铂(Pt)
79号元素-金(Au)
80号元素-汞(Hg)
81号元素-铊(Tl)
82号元素-铅(Pb)
83号元素-铋(Bi)
84号元素-钋(Po)
85号元素-砹(At)
86号元素-氡(Rn)
87号元素-钫(Fr)
88号元素-镭(Ra)
89号元素-锕(Ac)
90号元素-钍(Th)
91号元素-镤(Pa)
92号元素-铀(U)
93号元素-镎(Np)
94号元素-钚(Pu)
95号元素-镅(Am)
96号元素-锔(Cm)
97号元素-锫(Bk)
98号元素-锎(Cf)
99号元素-锿(Es)
100号元素-镄(Fm)
101号元素-钔(Md)
102号元素-锘(No)
103号元素-铹(Lr)
104号元素-𬬻(Rf)
105号元素-𬭊(Db)
106号元素-𬭳(Sg)
107号元素-𬭛(Bh)
108号元素-𬭶(Hs)
109号元素-鿏(Mt)
110号元素-𫟼(Ds)
111号元素-𬬭(Rg)
112号元素-鿔(Cn)
113号元素-鿭(Nh)
114号元素-𫓧(Fl)
115号元素-镆(Mc)
116号元素-𫟷(Lv)
117号元素-鿬(Ts)
118号元素-鿫(Og)