锂 (Li)
银白色固体
![元素[锂(Li)]](/element/element-7dc3fd4013618bbfcddbf1aeef23e3a6.jpg) 金属锂浮在煤油上
金属锂浮在煤油上
![元素[锂(Li)]](/element/element-7dc3fd4013618bbfcddbf1aeef23e3a6.jpg) 金属锂浮在煤油上
金属锂浮在煤油上
基本信息
| 原子序数 | 3 | 英文名 | Lithium |
|---|---|---|---|
| 所属分类 | 碱金属 | 原子量 | 6.94 u |
| 熔点 | 180.54 °C | 沸点 | 1342 °C |
| 能级 | 2, 1 | 电负性 | 0.98 |
| 电子亲和能 | 59.6 kJ/mol | 半径(计算法) | 167 pm |
| 电离能 |
第1电离能: 520.2 kJ/mol
第2电离能: 7298.1 kJ/mol
第3电离能: 11815.0 kJ/mol
|
||
| 密度(常规) | 535 kg/m³ | 硬度(布式) | N/A |
| 体积模量 | 11 GPa | 导热率 | 85 W/mK |
| 宇宙存量百分比 | 6.0E-7 % | ||
锂,一种化学元素,其化学符号为Li,原子序数为3,呈现出银白色金属外观。锂因其在常温下的低密度、低熔点特性以及卓越的电导性和热导性而备受瞩目,尤其值得注意的是,锂能够与水反应生成氢气,并能与氧气发生燃烧反应。作为最轻的金属之一,锂的应用范围广泛且重要。首要用途是在电池领域,尤其是锂离子电池,它们被广泛应用在便携式电子设备(例如手机、笔记本电脑)和电动车辆等现代科技产品中。此外,锂还用作合金成分以提升金属的强度和韧性,常见于航天器和飞机部件的制造。同时,锂的化合物在药物和陶瓷工业等领域也扮演着关键角色。 在获取锂资源方面,主要通过从含锂矿石如莫洛矿和斑脉石中进行提取,主要采用化学处理方式将锂从矿石中分离出来。然而,尽管锂具有诸多优点,但在处理过程中需格外谨慎。锂易燃且能与水剧烈反应生成氢气,因此必须避免其接触湿气或水分。另外,锂离子电池在特定条件下可能引发过热和短路现象,这就要求我们在使用和存储锂电池时采取必要的安全措施。尤其是在电池受损或处理不当的情况下,有可能导致有害物质泄漏,因此,正确处置和回收锂电池显得尤为重要。 最后强调,以上信息仅供参考,实际操作时务必严格遵循生产商提供的安全指南和操作建议,并确保充分理解和遵守当地的安全法规。
更多信息
| 电子排布 | 1s2 2s1 2, 1 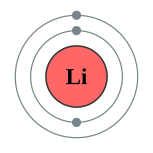 |
|---|---|
| 发现 | 约翰·奥古斯特·阿韦德松(1817年) |
| 分离 | 威廉·托马斯·布兰德(1821年) |
| 命名 | 永斯·贝吉里斯 |
| 物态 | 固态 |
| 密度 | (接近室温) 0.534 g·cm−3 |
| 临界点 | (估计) 3223 K,67 MPa |
| 熔化热 | 3.00 kJ·mol−1 |
| 汽化热 | 147.1 kJ·mol−1 |
| 比热容 | 24.860 J·mol−1·K−1 |
| 氧化态 | +1, -1 (强碱性氧化物) |
| 电负性 | 0.98(鲍林标度) |
| 原子半径 | 152 pm |
| 共价半径 | 128±7 pm |
| 范德华半径 | 182 pm |
| 晶体结构 | 体心立方 |
| 磁序 | 顺磁性 |
| 电阻率 | (20 °C)92.8 n Ω·m |
| 膨胀系数 | (25 °C)46 µm·m−1·K−1 |
| 声速(细棒) | (20 °C)6000 m·s−1 |
| 杨氏模量 | 4.9 GPa |
| 剪切模量 | 4.2 GPa |
| 体积模量 | 11 GPa |
| 莫氏硬度 | 0.6 |
元素列表
1号元素-氢(H)
2号元素-氦(He)
3号元素-锂(Li)
4号元素-铍(Be)
5号元素-硼(B)
6号元素-碳(C)
7号元素-氮(N)
8号元素-氧(O)
9号元素-氟(F)
10号元素-氖(Ne)
11号元素-钠(Na)
12号元素-镁(Mg)
13号元素-铝(Al)
14号元素-硅(Si)
15号元素-磷(P)
16号元素-硫(S)
17号元素-氯(Cl)
18号元素-氩(Ar)
19号元素-钾(K)
20号元素-钙(Ca)
21号元素-钪(Sc)
22号元素-钛(Ti)
23号元素-钒(V)
24号元素-铬(Cr)
25号元素-锰(Mn)
26号元素-铁(Fe)
27号元素-钴(Co)
28号元素-镍(Ni)
29号元素-铜(Cu)
30号元素-锌(Zn)
31号元素-镓(Ga)
32号元素-锗(Ge)
33号元素-砷(As)
34号元素-硒(Se)
35号元素-溴(Br)
36号元素-氪(Kr)
37号元素-铷(Rb)
38号元素-锶(Sr)
39号元素-钇(Y)
40号元素-锆(Zr)
41号元素-铌(Nb)
42号元素-钼(Mo)
43号元素-锝(Tc)
44号元素-钌(Ru)
45号元素-铑(Rh)
46号元素-钯(Pd)
47号元素-银(Ag)
48号元素-镉(Cd)
49号元素-铟(In)
50号元素-锡(Sn)
51号元素-锑(Sb)
52号元素-碲(Te)
53号元素-碘(I)
54号元素-氙(Xe)
55号元素-铯(Cs)
56号元素-钡(Ba)
57号元素-镧(La)
58号元素-铈(Ce)
59号元素-镨(Pr)
60号元素-钕(Nd)
61号元素-钷(Pm)
62号元素-钐(Sm)
63号元素-铕(Eu)
64号元素-钆(Gd)
65号元素-铽(Tb)
66号元素-镝(Dy)
67号元素-钬(Ho)
68号元素-铒(Er)
69号元素-铥(Tm)
70号元素-镱(Yb)
71号元素-镥(Lu)
72号元素-铪(Hf)
73号元素-钽(Ta)
74号元素-钨(W)
75号元素-铼(Re)
76号元素-锇(Os)
77号元素-铱(Ir)
78号元素-铂(Pt)
79号元素-金(Au)
80号元素-汞(Hg)
81号元素-铊(Tl)
82号元素-铅(Pb)
83号元素-铋(Bi)
84号元素-钋(Po)
85号元素-砹(At)
86号元素-氡(Rn)
87号元素-钫(Fr)
88号元素-镭(Ra)
89号元素-锕(Ac)
90号元素-钍(Th)
91号元素-镤(Pa)
92号元素-铀(U)
93号元素-镎(Np)
94号元素-钚(Pu)
95号元素-镅(Am)
96号元素-锔(Cm)
97号元素-锫(Bk)
98号元素-锎(Cf)
99号元素-锿(Es)
100号元素-镄(Fm)
101号元素-钔(Md)
102号元素-锘(No)
103号元素-铹(Lr)
104号元素-𬬻(Rf)
105号元素-𬭊(Db)
106号元素-𬭳(Sg)
107号元素-𬭛(Bh)
108号元素-𬭶(Hs)
109号元素-鿏(Mt)
110号元素-𫟼(Ds)
111号元素-𬬭(Rg)
112号元素-鿔(Cn)
113号元素-鿭(Nh)
114号元素-𫓧(Fl)
115号元素-镆(Mc)
116号元素-𫟷(Lv)
117号元素-鿬(Ts)
118号元素-鿫(Og)