碘 (I)
带金属光泽的紫灰色,蒸汽为紫色
![元素[碘(I)]](/element/element-fd6998770c2a502b671a4915fccaf410.jpg)
![元素[碘(I)]](/element/element-fd6998770c2a502b671a4915fccaf410.jpg)
基本資訊
| 原子序數 | 53 | 英文名 | Iodine |
|---|---|---|---|
| 所屬分類 | 活泼非金属 | 原子量 | 126.904 u |
| 熔點 | 113.7 °C | 沸點 | 184.3 °C |
| 能級 | 2, 8, 18, 18, 7 | 電負性 | 2.66 |
| 電子親和能 | 295.2 kJ/mol | 半徑(計算法) | 115 pm |
| 電離能 |
第1电离能: 1008.4 kJ/mol
第2电离能: 1845.9 kJ/mol
第3电离能: 3180 kJ/mol
|
||
| 密度(常規) | 4940 kg/m³ | 硬度(布式) | N/A |
| 體積模量 | 7.7 GPa | 導熱率 | 0.449 W/mK |
| 宇宙存量百分比 | 1.00E-7 % | ||
碘,化學符號為I,原子序為53,是一種非金屬元素,普遍存在於地球上的海洋和土壤之中。 其呈現藍黑色晶體形態,在室溫條件下即可實現固態到氣態的直接昇華過程,具備113.7°C的熔點以及184.3°C的沸點,密度大約為4.93 g/cm³。 儘管碘在水中不易溶解,但它卻能很好地溶於多種有機溶劑,例如酒精和環己烷。 碘在多個領域有著重要用途。 在醫藥衛生領域,碘憑藉其強大的消毒殺菌能力,被廣泛應用於傷口清潔消毒及口腔護理產品。 在食品工業上,為了防止碘缺乏症的發生,如甲狀腺腫大,碘通常以碘化物形式添加至食鹽中。 此外,碘還在化學實驗中充當識別澱粉物質的有效試劑。 碘的取得途徑主要包括透過燃燒富含碘的海藻或透過化學反應提煉含碘礦石。 典型的製備方法是利用碘化物與諸如過氧化氫或過氧化鈉等氧化劑反應來產生碘。 在安全性方面,處理碘時需格外謹慎。 高濃度的碘可能會對皮膚和眼睛造成刺激,操作人員應戴上防護手套和護目鏡。 雖然碘的毒性相對較低,但長期或過量攝取碘化物仍可能導致碘中毒,故需合理控制攝取量。 此外,碘在高溫或遇到明火的情況下容易生成有毒的碘化氫氣體,因此應避免其與易燃物質或氧化劑接觸,確保使用環境的安全。
更多資訊
| 標準原子質量 | 126.90447(3) |
|---|---|
| 電子排布 | [氪] 4d10 5s2 5p5 2, 8, 18, 18, 7 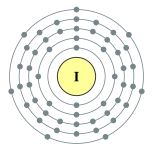 |
| 發現 | 貝爾納·庫爾圖瓦(1811年) |
| 分離 | 貝爾納·庫爾圖瓦(1811年) |
| 物態 | 固態 |
| 密度 | (接近室溫) 4.933 g·cm−3 |
| 三相點 | 386.65 K(113 °C),12.1 kPa |
| 臨界點 | 819 K,11.7 MPa |
| 熔化熱 | (I2)15.52 kJ·mol−1 |
| 汽化熱 | (I2)41.57 kJ·mol−1 |
| 比熱容 | (I2)54.44 J·mol−1·K−1 |
| 氧化態 | -1、+1、+2、+3、+4、+5、+6、+7 (強酸性氧化物) |
| 電負性 | 2.66(鮑林標度) |
| 原子半徑 | 140 pm |
| 共價半徑 | 139±3 pm |
| 范德華半徑 | 198 pm |
| 晶體結構 | 正交 |
| 磁序 | 抗磁性 |
| 磁化率 | −88.7×10−6 (298 K) cm3/mol |
| 電阻率 | (0 °C)1.3×107 Ω·m |
| 體積模量 | 7.7 GPa |
元素清單
1號元素-氫(H)
2號元素-氦(He)
3號元素-鋰(Li)
4號元素-鈹(Be)
5號元素-硼(B)
6號元素-碳(C)
7號元素-氮(N)
8號元素-氧(O)
9號元素-氟(F)
10號元素-氖(Ne)
11號元素-鈉(Na)
12號元素-鎂(Mg)
13號元素-鋁(Al)
14號元素-矽(Si)
15號元素-磷(P)
16號元素-硫(S)
17號元素-氯(Cl)
18號元素-氬(Ar)
19號元素-鉀(K)
20號元素-鈣(Ca)
21號元素-鈧(Sc)
22號元素-鈦(Ti)
23號元素-釩(V)
24號元素-鉻(Cr)
25號元素-錳(Mn)
26號元素-鐵(Fe)
27號元素-鈷(Co)
28號元素-鎳(Ni)
29號元素-銅(Cu)
30號元素-鋅(Zn)
31號元素-鎵(Ga)
32號元素-鍺(Ge)
33號元素-砷(As)
34號元素-硒(Se)
35號元素-溴(Br)
36號元素-氪(Kr)
37號元素-銣(Rb)
38號元素-鍶(Sr)
39號元素-釔(Y)
40號元素-鋯(Zr)
41號元素-鈮(Nb)
42號元素-鉬(Mo)
43號元素-鍀(Tc)
44號元素-釕(Ru)
45號元素-銠(Rh)
46號元素-鈀(Pd)
47號元素-銀(Ag)
48號元素-鎘(Cd)
49號元素-銦(In)
50號元素-錫(Sn)
51號元素-銻(Sb)
52號元素-碲(Te)
53號元素-碘(I)
54號元素-氙(Xe)
55號元素-銫(Cs)
56號元素-鋇(Ba)
57號元素-鑭(La)
58號元素-鈰(Ce)
59號元素-鐠(Pr)
60號元素-釹(Nd)
61號元素-鉕(Pm)
62號元素-釤(Sm)
63號元素-銪(Eu)
64號元素-釓(Gd)
65號元素-鋱(Tb)
66號元素-鏑(Dy)
67號元素-钬(Ho)
68號元素-鉺(Er)
69號元素-銩(Tm)
70號元素-鐿(Yb)
71號元素-鑥(Lu)
72號元素-鉿(Hf)
73號元素-鉭(Ta)
74號元素-鎢(W)
75號元素-錸(Re)
76號元素-鋨(Os)
77號元素-銥(Ir)
78號元素-鉑(Pt)
79號元素-金(Au)
80號元素-汞(Hg)
81號元素-鉈(Tl)
82號元素-鉛(Pb)
83號元素-鉍(Bi)
84號元素-釙(Po)
85號元素-砹(At)
86號元素-氡(Rn)
87號元素-鈁(Fr)
88號元素-鐳(Ra)
89號元素-錒(Ac)
90號元素-釷(Th)
91號元素-鏷(Pa)
92號元素-鈾(U)
93號元素-鎿(Np)
94號元素-鈈(Pu)
95號元素-鎇(Am)
96號元素-鋦(Cm)
97號元素-錇(Bk)
98號元素-鐦(Cf)
99號元素-鎄(Es)
100號元素-鐨(Fm)
101號元素-鍆(Md)
102號元素-鍩(No)
103號元素-鐒(Lr)
104號元素-鑪(Rf)
105號元素-𨧀(Db)
106號元素-𨭎(Sg)
107號元素-𨨏(Bh)
108號元素-𨭆(Hs)
109號元素-䥑(Mt)
110號元素-鐽(Ds)
111號元素-錀(Rg)
112號元素-鎶(Cn)
113號元素-鉨(Nh)
114號元素-鈇(Fl)
115號元素-鏌(Mc)
116號元素-鉝(Lv)
117號元素-鿬(Ts)
118號元素-鿫(Og)