碘 (I)
带金属光泽的紫灰色,蒸汽为紫色
![元素[碘(I)]](/element/element-fd6998770c2a502b671a4915fccaf410.jpg)
![元素[碘(I)]](/element/element-fd6998770c2a502b671a4915fccaf410.jpg)
基本信息
| 原子序数 | 53 | 英文名 | Iodine |
|---|---|---|---|
| 所属分类 | 活泼非金属 | 原子量 | 126.904 u |
| 熔点 | 113.7 °C | 沸点 | 184.3 °C |
| 能级 | 2, 8, 18, 18, 7 | 电负性 | 2.66 |
| 电子亲和能 | 295.2 kJ/mol | 半径(计算法) | 115 pm |
| 电离能 |
第1电离能: 1008.4 kJ/mol
第2电离能: 1845.9 kJ/mol
第3电离能: 3180 kJ/mol
|
||
| 密度(常规) | 4940 kg/m³ | 硬度(布式) | N/A |
| 体积模量 | 7.7 GPa | 导热率 | 0.449 W/mK |
| 宇宙存量百分比 | 1.00E-7 % | ||
碘,化学符号为I,原子序数为53,是一种非金属元素,普遍存在于地球上的海洋和土壤之中。其呈现出蓝黑色晶体形态,在室温条件下即可实现固态到气态的直接升华过程,具备113.7°C的熔点以及184.3°C的沸点,密度大约为4.93 g/cm³。尽管碘在水中不易溶解,但它却能很好地溶于多种有机溶剂,例如酒精和环己烷。 碘在多个领域有着重要用途。在医药卫生领域,碘凭借其强大的消毒杀菌能力,被广泛应用于伤口清洁消毒及口腔护理产品中。在食品工业上,为了防止碘缺乏症的发生,如甲状腺肿大,碘通常以碘化物形式添加至食盐中。此外,碘还在化学实验中充当识别淀粉物质的有效试剂。 碘的获取途径主要包括通过燃烧富含碘的海藻或通过化学反应提炼含碘矿石。典型的制备方法是利用碘化物与诸如过氧化氢或过氧化钠等氧化剂反应来生成碘。 在安全性方面,处理碘时需格外谨慎。高浓度的碘可能会对皮肤和眼睛造成刺激,操作人员应佩戴防护手套和护目镜。虽然碘的毒性相对较低,但长期或过量摄入碘化物仍可能导致碘中毒,故需合理控制摄入量。此外,碘在高温或遇到明火的情况下容易生成有毒的碘化氢气体,因此应避免其与易燃物质或氧化剂接触,确保使用环境的安全。
更多信息
| 电子排布 | [氪] 4d10 5s2 5p5 2, 8, 18, 18, 7 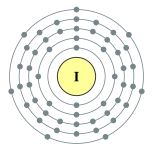 |
|---|---|
| 发现 | 贝尔纳·库尔图瓦(1811年) |
| 分离 | 贝尔纳·库尔图瓦(1811年) |
| 物态 | 固态 |
| 密度 | (接近室温) 4.933 g·cm−3 |
| 三相点 | 386.65 K(113 °C),12.1 kPa |
| 临界点 | 819 K,11.7 MPa |
| 熔化热 | (I2)15.52 kJ·mol−1 |
| 汽化热 | (I2)41.57 kJ·mol−1 |
| 比热容 | (I2)54.44 J·mol−1·K−1 |
| 氧化态 | -1、+1、+2、+3、+4、+5、+6、+7 (强酸性氧化物) |
| 电负性 | 2.66(鲍林标度) |
| 原子半径 | 140 pm |
| 共价半径 | 139±3 pm |
| 范德华半径 | 198 pm |
| 晶体结构 | 正交 |
| 磁序 | 抗磁性 |
| 磁化率 | −88.7×10−6 (298 K) cm3/mol |
| 电阻率 | (0 °C)1.3×107 Ω·m |
| 体积模量 | 7.7 GPa |
元素列表
1号元素-氢(H)
2号元素-氦(He)
3号元素-锂(Li)
4号元素-铍(Be)
5号元素-硼(B)
6号元素-碳(C)
7号元素-氮(N)
8号元素-氧(O)
9号元素-氟(F)
10号元素-氖(Ne)
11号元素-钠(Na)
12号元素-镁(Mg)
13号元素-铝(Al)
14号元素-硅(Si)
15号元素-磷(P)
16号元素-硫(S)
17号元素-氯(Cl)
18号元素-氩(Ar)
19号元素-钾(K)
20号元素-钙(Ca)
21号元素-钪(Sc)
22号元素-钛(Ti)
23号元素-钒(V)
24号元素-铬(Cr)
25号元素-锰(Mn)
26号元素-铁(Fe)
27号元素-钴(Co)
28号元素-镍(Ni)
29号元素-铜(Cu)
30号元素-锌(Zn)
31号元素-镓(Ga)
32号元素-锗(Ge)
33号元素-砷(As)
34号元素-硒(Se)
35号元素-溴(Br)
36号元素-氪(Kr)
37号元素-铷(Rb)
38号元素-锶(Sr)
39号元素-钇(Y)
40号元素-锆(Zr)
41号元素-铌(Nb)
42号元素-钼(Mo)
43号元素-锝(Tc)
44号元素-钌(Ru)
45号元素-铑(Rh)
46号元素-钯(Pd)
47号元素-银(Ag)
48号元素-镉(Cd)
49号元素-铟(In)
50号元素-锡(Sn)
51号元素-锑(Sb)
52号元素-碲(Te)
53号元素-碘(I)
54号元素-氙(Xe)
55号元素-铯(Cs)
56号元素-钡(Ba)
57号元素-镧(La)
58号元素-铈(Ce)
59号元素-镨(Pr)
60号元素-钕(Nd)
61号元素-钷(Pm)
62号元素-钐(Sm)
63号元素-铕(Eu)
64号元素-钆(Gd)
65号元素-铽(Tb)
66号元素-镝(Dy)
67号元素-钬(Ho)
68号元素-铒(Er)
69号元素-铥(Tm)
70号元素-镱(Yb)
71号元素-镥(Lu)
72号元素-铪(Hf)
73号元素-钽(Ta)
74号元素-钨(W)
75号元素-铼(Re)
76号元素-锇(Os)
77号元素-铱(Ir)
78号元素-铂(Pt)
79号元素-金(Au)
80号元素-汞(Hg)
81号元素-铊(Tl)
82号元素-铅(Pb)
83号元素-铋(Bi)
84号元素-钋(Po)
85号元素-砹(At)
86号元素-氡(Rn)
87号元素-钫(Fr)
88号元素-镭(Ra)
89号元素-锕(Ac)
90号元素-钍(Th)
91号元素-镤(Pa)
92号元素-铀(U)
93号元素-镎(Np)
94号元素-钚(Pu)
95号元素-镅(Am)
96号元素-锔(Cm)
97号元素-锫(Bk)
98号元素-锎(Cf)
99号元素-锿(Es)
100号元素-镄(Fm)
101号元素-钔(Md)
102号元素-锘(No)
103号元素-铹(Lr)
104号元素-𬬻(Rf)
105号元素-𬭊(Db)
106号元素-𬭳(Sg)
107号元素-𬭛(Bh)
108号元素-𬭶(Hs)
109号元素-鿏(Mt)
110号元素-𫟼(Ds)
111号元素-𬬭(Rg)
112号元素-鿔(Cn)
113号元素-鿭(Nh)
114号元素-𫓧(Fl)
115号元素-镆(Mc)
116号元素-𫟷(Lv)
117号元素-鿬(Ts)
118号元素-鿫(Og)