钔 (Md)
| 原子序数 | 101 | 英文名 | Mendelevium |
|---|---|---|---|
| 所属分类 | 锕系元素 | 原子量 | 258 u |
| 熔点 | 830 °C | 沸点 | 0 °C |
| 能级 | 2, 8, 18, 32, 31, 8, 2 | 电负性 | 1.3 |
| 电子亲和能 | N/A kJ/mol | 半径(计算法) | N/A pm |
| 电离能 |
第1电离能: 635 kJ/mol
第2电离能: 1235 kJ/mol
第3电离能: 2470 kJ/mol
第4电离能: 3840 kJ/mol
|
||
| 密度(常规) | N/A | 硬度(布式) | N/A |
| 体积模量 | N/A | 导热率 | N/A |
| 宇宙存量百分比 | 0 % | ||
钔,作为一种化学元素,其化学符号最初为Mv,后改为Md,原子序数为101,位于锕系元素序列倒数第三位,同时也是第九个超铀元素,表现出强烈的放射性属性,属于金属类别。钔拥有16种已知同位素,其中最稳定的同位素为258Md,半衰期长达51天;尽管如此,256Md的半衰期虽然仅有1.17小时,但由于能够更大规模地生成,故在化学实验中更为常用。不同于其他早期超铀元素可通过中子轰击轻元素获得,钔仅能通过粒子加速器加速带电粒子撞击轻元素以极少量的方式合成。 钔这一元素于1955年由科学家们通过用α粒子轰击锿元素成功发现,并沿用至今相同的合成方法。其名称“Mendelevium”是为了纪念元素周期表的创立者德米特里·伊万诺维奇·门捷列夫,起初采用的符号为Mv,后来在1963年正式更改为Md。利用几微克质量的锿-253作为靶材,每小时就能生成数以百万计的钔原子,但由于其生产量受限且所有同位素半衰期均较短,迄今为止,钔除科研用途外,并无其他实际应用领域。 在化学性质上,钔表现出了典型重锕系元素的特点,通常以+3氧化态存在,但也能够形成相对稳定的+2氧化态,且其化学性质与铥相近。钔呈现银白色金属光泽,具有较高的熔点和沸点,在室温下虽相对稳定,但会在空气中缓慢氧化。由于其放射性,钔对生物体具有潜在的危害性。 在用途方面,由于钔难以大量制备及其放射性同位素的短半衰期限制,其实际用途局限于科学研究和实验室分析工作。其制备方法主要依赖于重离子核反应技术,即通过加速重离子束轰击目标材料,形成含有所需放射性核素的中间产物,随后运用化学分离手段提取出钔元素。 在安全方面,鉴于钔的高度放射性和毒性,处理过程中要求严格遵守辐射防护措施,最大限度降低辐射暴露风险,并防止直接接触和吸入,同时需要按照特殊的安全操作规程妥善处理和储存。
| 电子排布 | [Rn] 5f13 7s2 2, 8, 18, 32, 31, 8, 2 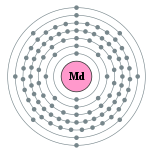 |
|---|---|
| 发现 | 劳伦斯伯克利国家实验室(1955年) |
| 物态 | 固体 |
| 密度 | (接近室温) 10.3(7) g·cm−3 |
| 氧化态 | +2、+3 |
| 电负性 | 1.3(鲍林标度) |
| 磁序 | 无数据 |
元素列表