氫 (H)
无色气体
![元素[氫(H)]](/element/element-eb3af7dacffcf46cd5ec16431240c17c.jpg) 等离子态下发出的浅紫光
等离子态下发出的浅紫光
![元素[氫(H)]](/element/element-eb3af7dacffcf46cd5ec16431240c17c.jpg) 等离子态下发出的浅紫光
等离子态下发出的浅紫光
基本資訊
| 原子序數 | 1 | 英文名 | Hydrogen |
|---|---|---|---|
| 所屬分類 | 活泼非金属 | 原子量 | 1.008 u |
| 熔點 | -259.1 °C | 沸點 | -252.9 °C |
| 能級 | 1 | 電負性 | 2.20 |
| 電子親和能 | 72.8 kJ/mol | 半徑(計算法) | 53 pm |
| 電離能 |
第1电离能: 1312.0 kJ/mol
|
||
| 密度(常規) | 0.0899 kg/m³ | 硬度(布式) | N/A |
| 體積模量 | N/A | 導熱率 | 0.1805 W/mK |
| 宇宙存量百分比 | 75 % | ||
氫氣,一種無色、無臭且極為輕盈的氣體,其密度遠低於空氣,是自然界中最輕的元素,在常態下呈現為氣體狀態。 它具有獨特的化學性質,不僅高度易燃,能與空氣中的氧氣形成爆炸性混合物,而且燃燒後的唯一副產物是水,使得氫氣在多個領域展現出廣泛應用潜力。 在工業生產中,氫氣因具備不產生有害物質的優點,被廣泛應用於氫氣氣體保護焊接工藝,對焊接高品質及高純度金屬材料至關重要; 同時,煉油工業也利用氫氣進行加氫反應,有效去除石油產品中的雜質和不飽和化合物。 此外,氫氣還被視為氫燃料電池的理想燃料,有望在交通運輸和能源產業中發揮重要作用。 獲取氫氣的方法多種多樣,工業上最常見的是通過蒸汽重整或部分氧化瓦斯的管道制取,而在實驗室條件下,則可通過鋅、鋁等金屬與鹽酸等酸溶液間的反應來製備。 然而,鑒於氫氣的高度易燃性,其與空氣混合形成的爆炸極限範圍為4%-74%,囙此在操作和儲存過程中必須嚴格遵守安全規定。 氫氣應儲藏於通風良好處,並遠離火源、火花和熱源,同時在操作時採用合適的容器和防漏裝置,確保安全。 值得注意的是,由於高濃度氫氣可能導致窒息,囙此不可直接吸入。 總之,在涉及氫氣的任何操作之前,請務必充分瞭解並嚴格遵循相關的安全規定與建議。
更多資訊
| 標準原子質量 | 1.008 |
|---|---|
| 電子排布 | 1s1 1 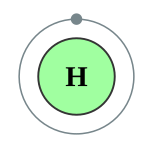 |
| 發現 | 亨利·卡文迪什(1766年) |
| 命名 | 安東萬-羅倫·德·拉瓦節(1783年) |
| 物態 | 氣體 |
| 密度 | (0 °C, 101.325 kPa) 0.08988 g/L |
| 三相點 | 13.8033 K(−259 °C),7.041 kPa |
| 臨界點 | 32.938 K,1.2858 MPa |
| 熔化熱 | (H2)0.117 kJ·mol−1 |
| 汽化熱 | (H2)0.904 kJ·mol−1 |
| 比熱容 | (H2)28.836 J·mol−1·K−1 |
| 氧化態 | −1, +1 (兩性氧化物) |
| 電負性 | 2.20(鮑林標度) |
| 共價半徑 | 31±5 pm |
| 范德華半徑 | 120 pm |
| 晶體結構 | 六方 |
| 磁序 | 抗磁性 |
| 聲速 | 1310 m·s−1 |
元素清單
1號元素-氫(H)
2號元素-氦(He)
3號元素-鋰(Li)
4號元素-鈹(Be)
5號元素-硼(B)
6號元素-碳(C)
7號元素-氮(N)
8號元素-氧(O)
9號元素-氟(F)
10號元素-氖(Ne)
11號元素-鈉(Na)
12號元素-鎂(Mg)
13號元素-鋁(Al)
14號元素-矽(Si)
15號元素-磷(P)
16號元素-硫(S)
17號元素-氯(Cl)
18號元素-氬(Ar)
19號元素-鉀(K)
20號元素-鈣(Ca)
21號元素-鈧(Sc)
22號元素-鈦(Ti)
23號元素-釩(V)
24號元素-鉻(Cr)
25號元素-錳(Mn)
26號元素-鐵(Fe)
27號元素-鈷(Co)
28號元素-鎳(Ni)
29號元素-銅(Cu)
30號元素-鋅(Zn)
31號元素-鎵(Ga)
32號元素-鍺(Ge)
33號元素-砷(As)
34號元素-硒(Se)
35號元素-溴(Br)
36號元素-氪(Kr)
37號元素-銣(Rb)
38號元素-鍶(Sr)
39號元素-釔(Y)
40號元素-鋯(Zr)
41號元素-鈮(Nb)
42號元素-鉬(Mo)
43號元素-鍀(Tc)
44號元素-釕(Ru)
45號元素-銠(Rh)
46號元素-鈀(Pd)
47號元素-銀(Ag)
48號元素-鎘(Cd)
49號元素-銦(In)
50號元素-錫(Sn)
51號元素-銻(Sb)
52號元素-碲(Te)
53號元素-碘(I)
54號元素-氙(Xe)
55號元素-銫(Cs)
56號元素-鋇(Ba)
57號元素-鑭(La)
58號元素-鈰(Ce)
59號元素-鐠(Pr)
60號元素-釹(Nd)
61號元素-鉕(Pm)
62號元素-釤(Sm)
63號元素-銪(Eu)
64號元素-釓(Gd)
65號元素-鋱(Tb)
66號元素-鏑(Dy)
67號元素-钬(Ho)
68號元素-鉺(Er)
69號元素-銩(Tm)
70號元素-鐿(Yb)
71號元素-鑥(Lu)
72號元素-鉿(Hf)
73號元素-鉭(Ta)
74號元素-鎢(W)
75號元素-錸(Re)
76號元素-鋨(Os)
77號元素-銥(Ir)
78號元素-鉑(Pt)
79號元素-金(Au)
80號元素-汞(Hg)
81號元素-鉈(Tl)
82號元素-鉛(Pb)
83號元素-鉍(Bi)
84號元素-釙(Po)
85號元素-砹(At)
86號元素-氡(Rn)
87號元素-鈁(Fr)
88號元素-鐳(Ra)
89號元素-錒(Ac)
90號元素-釷(Th)
91號元素-鏷(Pa)
92號元素-鈾(U)
93號元素-鎿(Np)
94號元素-鈈(Pu)
95號元素-鎇(Am)
96號元素-鋦(Cm)
97號元素-錇(Bk)
98號元素-鐦(Cf)
99號元素-鎄(Es)
100號元素-鐨(Fm)
101號元素-鍆(Md)
102號元素-鍩(No)
103號元素-鐒(Lr)
104號元素-鑪(Rf)
105號元素-𨧀(Db)
106號元素-𨭎(Sg)
107號元素-𨨏(Bh)
108號元素-𨭆(Hs)
109號元素-䥑(Mt)
110號元素-鐽(Ds)
111號元素-錀(Rg)
112號元素-鎶(Cn)
113號元素-鉨(Nh)
114號元素-鈇(Fl)
115號元素-鏌(Mc)
116號元素-鉝(Lv)
117號元素-鿬(Ts)
118號元素-鿫(Og)