鈣 (Ca)
银白色
![元素[鈣(Ca)]](/element/element-0e8388a9bc384cfde33385cbfac05cf7.jpg)
![元素[鈣(Ca)]](/element/element-0e8388a9bc384cfde33385cbfac05cf7.jpg)
基本資訊
| 原子序數 | 20 | 英文名 | Calcium |
|---|---|---|---|
| 所屬分類 | 碱土金属 | 原子量 | 40.078 u |
| 熔點 | 841.9 °C | 沸點 | 1484 °C |
| 能級 | 2, 8, 8, 2 | 電負性 | 1.0 |
| 電子親和能 | 2.37 kJ/mol | 半徑(計算法) | 194 pm |
| 電離能 |
第1电离能: 589.8 kJ/mol
第2电离能: 1145.4 kJ/mol
第3电离能: 4912.4 kJ/mol
第4电离能: 6491 kJ/mol
第5电离能: 8153 kJ/mol
第6电离能: 10496 kJ/mol
第7电离能: 12270 kJ/mol
第8电离能: 14206 kJ/mol
第9电离能: 18191 kJ/mol
第10电离能: 20385 kJ/mol
第11电离能: 57110 kJ/mol
第12电离能: 63410 kJ/mol
第13电离能: 70110 kJ/mol
第14电离能: 78890 kJ/mol
第15电离能: 86310 kJ/mol
第16电离能: 94000 kJ/mol
第17电离能: 104900 kJ/mol
第18电离能: 111711 kJ/mol
第19电离能: 494850 kJ/mol
第20电离能: 527762 kJ/mol
|
||
| 密度(常規) | 1550 kg/m³ | 硬度(布式) | 167 MPa |
| 體積模量 | 17 GPa | 導熱率 | 200 W/mK |
| 宇宙存量百分比 | 0.0070 % | ||
鈣,作為一種常見的化學元素,其化學符號為Ca,原子序為20,具備一系列獨特的物理和化學性質。 在自然狀態下,鈣呈現出銀白色的金屬光澤,並具有優良的電導率和熱導性能,以及良好的可塑性和延展性,能夠輕易地被打成薄片或拉伸成線。 儘管在常溫常壓下相對穩定,但鈣會與氧氣及水發生反應,釋放出氫氣,這揭示了其活潑的化學屬性,作為鹼土金屬家族的一員,鈣遇酸會發生置換反應,生成相應 的鈣鹽和水。 在實際應用中,鈣的用途十分廣泛。 一方面,它被大量用於製備各種鈣化合物,包括鈣鹽、石灰石和石膏等基礎材料;另一方面,鈣在冶金工業中扮演重要角色,作為還原劑從金屬氧化物中提取金屬。 此外,農業領域中,鈣以其石灰肥料的形式調節土壤pH值,提升土壤肥力;而在製造業中,鈣也被應用於合金製造、電池組件以及火星塞等高科技產品的生產。 在工業規模上,鈣的製備通常是透過電解熔融的鈣化合物,如氯化鈣來實現;實驗室條件下,則可透過鈣與酸反應生成氫氣的方式來製取鈣。 關於安全性,操作鈣時需要特別注意若干風險因子。 首先,鈣與水反應產生的氫氣可能帶來爆炸隱患;其次,鈣粉末具有易燃性,故應遠離火源;此外,直接接觸鈣可能會導致皮膚刺激和灼傷,因此必須避免裸手接觸。 最後,諸如鈣鹽和氫氧化鈣一類的鈣化合物往往呈現鹼性,使用時務必小心防範鹼性灼傷的可能性。 總之,雖然上述內容僅是對鈣的基本介紹,但在實際運用鈣及其化合物時,仍需依據特定情境和要求進行更為細緻、深入的研究和了解。
更多資訊
| 標準原子質量 | 40.078(4) |
|---|---|
| 電子排布 | [Ar] 4s2 2, 8, 8, 2 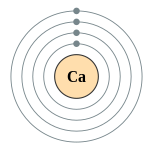 |
| 發現 | 漢弗里·戴維(1808年) |
| 分離 | 漢弗里·戴維(1808年) |
| 物態 | 固態 |
| 密度 | (接近室溫) 1.55 g·cm−3 |
| 熔化熱 | 8.54 kJ·mol−1 |
| 汽化熱 | 154.7 kJ·mol−1 |
| 比熱容 | 25.929 J·mol−1·K−1 |
| 氧化態 | +2, +1 (強鹼性) |
| 電負性 | 1.00(鮑林標度) |
| 原子半徑 | 197 pm |
| 共價半徑 | 176±10 pm |
| 范德華半徑 | 231 pm |
| 晶體結構 | 面心立方 |
| 磁序 | 抗磁性 |
| 磁化率 | +40.0×10−6 cm3/mol |
| 電阻率 | (20 °C)33.6 n Ω·m |
| 膨脹系數 | (25 °C)22.3 µm·m−1·K−1 |
| 聲速(細棒) | (20 °C)3810 m·s−1 |
| 楊氏模量 | 20 GPa |
| 剪切模量 | 7.4 GPa |
| 體積模量 | 17 GPa |
| 泊松比 | 0.31 |
| 莫氏硬度 | 1.75 |
| 布氏硬度 | 167 MPa |
元素清單
1號元素-氫(H)
2號元素-氦(He)
3號元素-鋰(Li)
4號元素-鈹(Be)
5號元素-硼(B)
6號元素-碳(C)
7號元素-氮(N)
8號元素-氧(O)
9號元素-氟(F)
10號元素-氖(Ne)
11號元素-鈉(Na)
12號元素-鎂(Mg)
13號元素-鋁(Al)
14號元素-矽(Si)
15號元素-磷(P)
16號元素-硫(S)
17號元素-氯(Cl)
18號元素-氬(Ar)
19號元素-鉀(K)
20號元素-鈣(Ca)
21號元素-鈧(Sc)
22號元素-鈦(Ti)
23號元素-釩(V)
24號元素-鉻(Cr)
25號元素-錳(Mn)
26號元素-鐵(Fe)
27號元素-鈷(Co)
28號元素-鎳(Ni)
29號元素-銅(Cu)
30號元素-鋅(Zn)
31號元素-鎵(Ga)
32號元素-鍺(Ge)
33號元素-砷(As)
34號元素-硒(Se)
35號元素-溴(Br)
36號元素-氪(Kr)
37號元素-銣(Rb)
38號元素-鍶(Sr)
39號元素-釔(Y)
40號元素-鋯(Zr)
41號元素-鈮(Nb)
42號元素-鉬(Mo)
43號元素-鍀(Tc)
44號元素-釕(Ru)
45號元素-銠(Rh)
46號元素-鈀(Pd)
47號元素-銀(Ag)
48號元素-鎘(Cd)
49號元素-銦(In)
50號元素-錫(Sn)
51號元素-銻(Sb)
52號元素-碲(Te)
53號元素-碘(I)
54號元素-氙(Xe)
55號元素-銫(Cs)
56號元素-鋇(Ba)
57號元素-鑭(La)
58號元素-鈰(Ce)
59號元素-鐠(Pr)
60號元素-釹(Nd)
61號元素-鉕(Pm)
62號元素-釤(Sm)
63號元素-銪(Eu)
64號元素-釓(Gd)
65號元素-鋱(Tb)
66號元素-鏑(Dy)
67號元素-钬(Ho)
68號元素-鉺(Er)
69號元素-銩(Tm)
70號元素-鐿(Yb)
71號元素-鑥(Lu)
72號元素-鉿(Hf)
73號元素-鉭(Ta)
74號元素-鎢(W)
75號元素-錸(Re)
76號元素-鋨(Os)
77號元素-銥(Ir)
78號元素-鉑(Pt)
79號元素-金(Au)
80號元素-汞(Hg)
81號元素-鉈(Tl)
82號元素-鉛(Pb)
83號元素-鉍(Bi)
84號元素-釙(Po)
85號元素-砹(At)
86號元素-氡(Rn)
87號元素-鈁(Fr)
88號元素-鐳(Ra)
89號元素-錒(Ac)
90號元素-釷(Th)
91號元素-鏷(Pa)
92號元素-鈾(U)
93號元素-鎿(Np)
94號元素-鈈(Pu)
95號元素-鎇(Am)
96號元素-鋦(Cm)
97號元素-錇(Bk)
98號元素-鐦(Cf)
99號元素-鎄(Es)
100號元素-鐨(Fm)
101號元素-鍆(Md)
102號元素-鍩(No)
103號元素-鐒(Lr)
104號元素-鑪(Rf)
105號元素-𨧀(Db)
106號元素-𨭎(Sg)
107號元素-𨨏(Bh)
108號元素-𨭆(Hs)
109號元素-䥑(Mt)
110號元素-鐽(Ds)
111號元素-錀(Rg)
112號元素-鎶(Cn)
113號元素-鉨(Nh)
114號元素-鈇(Fl)
115號元素-鏌(Mc)
116號元素-鉝(Lv)
117號元素-鿬(Ts)
118號元素-鿫(Og)