- 1 H 氢 (qīng) 1.008
- 2 He 氦 (hài) 4.0026
- 3 Li 锂 (lǐ) 6.94
- 4 Be 铍 (pí) 9.0122
- 5 B 硼 (péng) 10.81
- 6 C 碳 (tàn) 12.011
- 7 N 氮 (dàn) 14.007
- 8 O 氧 (yǎng) 15.999
- 9 F 氟 (fú) 18.998
- 10 Ne 氖 (nǎi) 20.180
- 11 Na 钠 (nà) 22.990
- 12 Mg 镁 (měi) 24.305
- 13 Al 铝 (lǚ) 26.982
- 14 Si 硅 (guī) 28.085
- 15 P 磷 (lín) 30.974
- 16 S 硫 (liú) 32.06
- 17 Cl 氯 (lǜ) 35.45
- 18 Ar 氩 (yà) 39.948
- 19 K 钾 (jiǎ) 39.098
- 20 Ca 钙 (gài) 40.078
- 21 Sc 钪 (kàng) 44.956
- 22 Ti 钛 (tài) 47.867
- 23 V 钒 (fán) 50.942
- 24 Cr 铬 (gè) 51.996
- 25 Mn 锰 (měng) 54.938
- 26 Fe 铁 (tiě) 55.845
- 27 Co 钴 (gǔ) 58.933
- 28 Ni 镍 (niè) 58.693
- 29 Cu 铜 (tóng) 63.546
- 30 Zn 锌 (xīn) 65.38
- 31 Ga 镓 (jiā) 69.723
- 32 Ge 锗 (zhě) 72.630
- 33 As 砷 (shēn) 74.922
- 34 Se 硒 (xī) 78.971
- 35 Br 溴 (xiù) 79.904
- 36 Kr 氪 (kè) 83.798
- 37 Rb 铷 (rú) 85.468
- 38 Sr 锶 (sī) 87.62
- 39 Y 钇 (yǐ) 88.906
- 40 Zr 锆 (gào) 91.224
- 41 Nb 铌 (ní) 92.906
- 42 Mo 钼 (mù) 95.95
- 43 Tc 锝 (dé) (98)
- 44 Ru 钌 (liǎo) 101.07
- 45 Rh 铑 (lǎo) 102.91
- 46 Pd 钯 (bǎ) 106.42
- 47 Ag 银 (yín) 107.87
- 48 Cd 镉 (gé) 112.41
- 49 In 铟 (yīn) 114.82
- 50 Sn 锡 (xī) 118.71
- 51 Sb 锑 (tī) 121.76
- 52 Te 碲 (dì) 127.60
- 53 I 碘 (diǎn) 126.90
- 54 Xe 氙 (xiān) 131.29
- 55 Cs 铯 (sè) 132.91
- 56 Ba 钡 (bèi) 137.33
- 57 La 镧 (lán) 138.91
- 58 Ce 铈 (shì) 140.12
- 59 Pr 镨 (pǔ) 140.91
- 60 Nd 钕 (nǚ) 144.24
- 61 Pm 钷 (pǒ) (145)
- 62 Sm 钐 (shān) 150.36
- 63 Eu 铕 (yǒu) 151.96
- 64 Gd 钆 (gá) 157.25
- 65 Tb 铽 (tè) 158.93
- 66 Dy 镝 (dī) 162.50
- 67 Ho 钬 (huǒ) 164.93
- 68 Er 铒 (ěr) 167.26
- 69 Tm 铥 (diū) 168.93
- 70 Yb 镱 (yì) 173.05
- 71 Lu 镥 (lǔ) 174.97
- 72 Hf 铪 (hā) 178.49
- 73 Ta 钽 (tǎn) 180.95
- 74 W 钨 (wū) 183.84
- 75 Re 铼 (lái) 186.21
- 76 Os 锇 (é) 190.23
- 77 Ir 铱 (yī) 192.22
- 78 Pt 铂 (bó) 195.08
- 79 Au 金 (jīn) 196.97
- 80 Hg 汞 (gǒng) 200.59
- 81 Tl 铊 (tā) 204.38
- 82 Pb 铅 (tā) 207.2
- 83 Bi 铋 (bì) 208.98
- 84 Po 钋 (pō) (209)
- 85 At 砹 (ài) (210)
- 86 Rn 氡 (dōnɡ) (222)
- 87 Fr 钫 (fānɡ) (223)
- 88 Ra 镭 (léi) (226)
- 89 Ac 锕 (ā) (227)
- 90 Th 钍 (tǔ) 232.04
- 91 Pa 镤 (pú) 231.04
- 92 U 铀 (yóu) 238.03
- 93 Np 镎 (ná) (237)
- 94 Pu 钚 (bù) (244)
- 95 Am 镅 (méi) (243)
- 96 Cm 锔 (jú) (247)
- 97 Bk 锫 (péi) (247)
- 98 Cf 锎 (kāi) (251)
- 99 Es 锿 (āi) (252)
- 100 Fm 镄 (fèi) (257)
- 101 Md 钔 (mén) (258)
- 102 No 锘 (nuò) (259)
- 103 Lr 铹 (láo) (266)
- 104 Rf 𬬻 (lú) (267)
- 105 Db 𬭊 (dù) (268)
- 106 Sg 𬭳 (xǐ) (269)
- 107 Bh 𬭛 (bō) (270)
- 108 Hs 𬭶 (hēi) (277)
- 109 Mt 鿏 (mài) (278)
- 110 Ds 𫟼 (dá) (281)
- 111 Rg 𬬭 (lún) (282)
- 112 Cn 鿔 (ɡē) (285)
- 113 Nh 鉨 (nǐ) (286)
- 114 Fl 𫓧 (fū) (289)
- 115 Mc 镆 (mò) (290)
- 116 Lv 𫟷 (lì) (293)
-
117
Ts
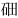 (tián)
(294)
(tián)
(294)
-
118
Og
 (ào)
(294)
(ào)
(294)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15氮族元素
16氧族元素
17卤素
18
序号
符号
名称
原子质量
1
2
3
4
5
6
57–71
6
7
89–103
7
对于没有稳定同位素的元素,以括号标出半衰期最长的核素的相对原子质量。